
美国研究人员Nhan
Le等开发了一种集成的多功能成像系统,使用该系统,能够在眼科应用中实现活体内解剖(OCT)、功能(OCTA)和分子成像(LIAF)。其中LIAF使用蓝色激发光(405
nm),OCT提供1310 nm扫描激光源。带有450
nm切入式宽带滤光片的RGB数码相机用于LIAF探测。激发光源和相机与OCT探头直接集成在一起。不但保持了检测健康牙齿和低矿化牙齿之间的差异、识别牙齿生物膜和可视化牙龈组织微血管的能力,集成系统还提高了体内OCT数据收集的速度,并能够更好地瞄准ROI区域。集成OCT-LIAF系统为临床研究提供了更多信息和便利性,方便操作者更好的检查口腔状况随时间的变化情况。文章以“Non-invasive
multimodal imaging by integratingoptical coherence tomography with
autofluorescence imaging for dental applications”为题发表于Journal of Biophotonics。
背景
目前对牙周健康和疾病状况的监测主要通过牙科人员依靠视觉和触觉评估来进行。临床评估基于颜色、质地、探查出血、牙龈组织肿胀、牙周袋深度和附着性测量。早在20世纪80年代早期,就已经开发出了一系列非破坏性和非侵入性成像方法,可用于检测早期龋齿病变,如激光诱导自荧光。当时人们已知紫外线和蓝色激发后牙齿会发出荧光,使用488
nm激光对釉质病变进行成像非常普遍。发出的诱导荧光处于光谱的绿色或红色区域。绿色自荧光源于牙本质层胶原蛋白,而红色荧光源于细菌代谢产物,主要是牙菌斑膜上的卟啉等。当釉质内出现龋齿时,病变会吸收并散射激发光,导致自荧光强度较低。虽然LIAF能够充分检测牙釉质病变和成熟的牙菌斑,但不能直接提供深度信息,因此,如果能直接测量出病变深度,对牙齿状况会有更准确更有效的评估。
OCT是一种相对较新的医学成像方式,在眼科和牙科临床应用中都获得很好的效果。典型的OCT系统与断层扫描技术类似,能够进行体积式扫描,揭示扫描表面下的潜在结构特征。OCT系统通常采用近红外至红外光源(600-1400
nm)提取生物组织的散射特性,能够以几微米的分辨率对生物组织表面以下2 mm的微结构成像,通常在组织中的轴向分辨率为6
μm,横向分辨率取决于扫描光学器件从12至50
μm不等。眼科相关疾病的诊断和监测中应该非常普遍,例如黄斑变性、青光眼和糖尿病视网膜病变。牙科临床中,同样被用于识别龋齿和牙结石,测量龈沟的深度,表征牙周组织轮廓。
早在20世纪80年代中期人们就将干涉测量法用于眼科研究,后不断开发和完善并用于眼科医学成像。在眼科引入OCT后,皮肤科、脑、癌症影像学等诸多其他领域开始研究其临床应用潜力。OCT在20世纪90年代后期被用于牙周病学。然而大多数牙龈组织的OCT研究于研究组织的解剖结构。近的研究已经将OCT技术应用于临床,以评估作为治疗功能的软组织和硬组织的变化。
OCT中的功能性血管造影(OCTA)技术可以对牙龈组织内的脉管系统成像。然而,高分辨率OCT技术对扫描区域具有高度特异性,因此受限于小视场(~
8 mm × 8
mm),而小视场虽然分辨率高(微米和毛细管水平尺度),但很难与临床视觉评估进行直接比较。除此之外,考虑到OCT的高分辨率能力,参与者的呼吸活动也可能会干扰测量;在一些关键性的牙齿区域,操作者的视线被遮挡,OCT探针布置较难。本研究通过在OCT系统中集成LIAF来解决这些问题,使操作者可靠地瞄准感兴趣的区域,并抵消由于患者呼吸或其他形式的运动引起的任何移动。从而提高OCT系统的可靠性,减少探头对准时间,从而获得统一、聚焦、高质量3D图像,为临床评估提供有价值的信息。
结果
01-光诱导的荧光成像
LIAF-OCT集成系统中,OCT可提供牙菌斑的总体信息,LIAF可检测更成熟和更具潜在致病性的斑块。牙齿结构异常方面,OCT可提供牙齿三维高分辨图像,LIAF可通过绿色荧光的变化反映牙齿结构异常。
图3为低矿化区和健康牙齿的LIAF图像。其中蓝色是LIAF光源的直接反射的结果。荧光图像可见低矿化区域显示为棕色斑块,绿色自荧光显著减少(图3A)。将绿色和红色通道获得的数据进一步处理并以灰度显示,可见健康牙釉质呈现为亮白色,低矿化区亮度较低(图3B)。与图3A中健康和低矿化区域位置相对应。低矿化区域还产生红色自荧光,在图3C中被感知为灰色区域(550-700
nm,620
mm峰)。已知红色自发荧光与细菌感染有关,卟啉是细菌代谢的产物,会积累并产生红色自动荧光。图3C中低矿化区域的红色自荧光弱于齿间和牙龈边缘区域(箭头),即生物膜积累的区域。该区域由于没有牙齿结构抑制光发射,因此红色自荧光更强。这些观察结果与之前文献中报道的结果非常一致。
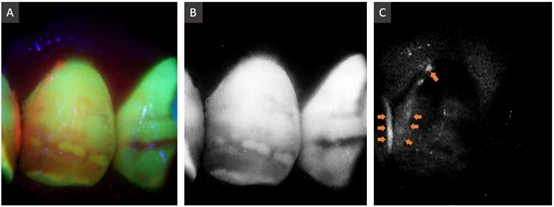
图3 (A)3通道相机的原始荧光图像(520 nm滤光片)。(B)绿色通道(450-600 nm, 520 nm峰)。(C)红色通道(550-800 nm, 640 nm峰)。
为证明斑块自荧光对比增强法(plaque-autofluorescence contrast enhancement,
PAF)在该集成系统中的作用,在刷牙前后对健康牙齿的牙菌斑情况进行了成像研究。志愿者在图像采集的早上没有刷牙,在左犬齿(近颊侧)检测到牙菌斑。次图像采集后,立即彻底刷牙以清除牙菌斑。
PAF法利用rLIAF(红色通道)和gLIAF(绿色通道)中自荧光强度的差异。在牙齿样本中(图4A),平均rLIAF强度为46,平均gLIAF强度为135;而斑块样品中二者平均强度都约为80(图4B)。由于牙齿的荧光光谱较宽,其荧光峰值在绿色光谱中,致使绝大多数信号出现在绿色检测通道(gLIAF)中,红色检测通道(rLIAF)中只有少量的低强度信号。鉴于红色和绿色通道中的自荧光强度遵循线性比例关系,因此引入PAF步骤,通过如下公式将红色通道图像从绿色通道图像中减去,进一步增强牙齿和牙斑的自荧光之间的差异: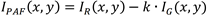
其中IPAF、IR、IG分别为增强后的斑块自荧光强度、红色通道(rLIAF)和绿色通道(gLIAF)强度,校准常数k通常<1,xy为图像中像素位置。

图4. (A,B)红色绿色通道以及PAF法的直方图。鉴于牙齿和斑块在不同自荧光光谱中强度不同,PAF法能将牙齿自荧光减少到基线值(0)并增强斑块自荧光的对比度。(C,D)原始数据图像。(E,F)红色自荧光显示牙齿也有很亮的自荧光,可能会减少斑块自荧光的对比度。(G,H)增强斑块可视化的的PAF法处理后的斑块图像。
图4C和4D为原始图像,由于牙齿的自荧光谱相对较宽,牙菌斑rLIAF中包含了来自牙齿的强背景噪声,需要进一步处理以进行可视化。图4G和4H为在斑块区域应用PAF算法后得到的对比增强图像。
通过使用PAF算法使来自牙齿的像素强度接近于零(图4A),而来自牙斑的像素(图4B)移动到非零值,从而改善斑块的可视化效果,在定量测量中,该方法较手动分割更为简便。经测量刷牙前后的菌斑面积值(N=10)分别为4.34±0.13 mm2和1.60±0.18 mm2,平均PAF强度分别为45.1±0.55和18.65±0.50。刷牙后,牙菌斑面积和PAF强度都显著降低。
以上结果证明该集成系统能够使用绿色自荧光检测牙釉质脱矿、使用红色自荧光检测斑块(生物膜)的存在。且所有成像都可以实时按需进行。
02-PAF和OCT对牙菌斑的定性观察
与LIAF类似,OCT也可以检测牙齿结构的变化和牙齿表面菌斑的积聚,此外OCTA还能提供牙龈组织的结构和血管信息。在OCT中,斑块由于亮度不连续,能够与周围(软/硬)组织区分开来,在正面投影和B-frame上可见暗条纹(图5)。在OCT
B-frame中,牙菌斑位于游离龈和牙齿之间,此处由于牙菌斑存在,牙龈出现轻微移位。斑块上似乎也可见一层20-30
μm厚的透明薄膜。在OCT正面投影中,牙斑呈平滑明亮的区域,特点是比牙釉质更亮(具有更高的散射特性)、纹理比周围软组织更平滑、齿间亮度不连续。OCT成像深度为表面下100
μm,该深度下牙斑面积完整,牙釉质层可以容易地与牙菌斑区分开,并且软组织中的脉管系统可以提供部分软组织炎症信息。

图5 颊侧齿间牙龈(左门牙和侧门牙之间)自荧光成像和OCT成像的对比。
与PAF图像相比,OCT图像中牙菌斑表面积看起来更大。OCT能够成像总斑块,而PAF只检测由产生卟啉的细菌菌株组成的斑块。因此将PAF作为唯一的评估技术可能无法准确评估牙菌斑存在情况,但可以追踪斑块生物膜的生长及其活性。
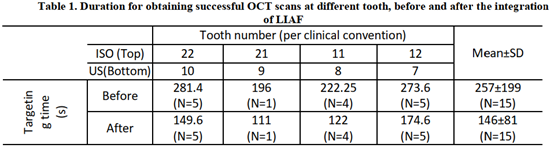
在介入和基于纵向的临床研究中,图像配准非常重要。LIAF可以在扫描过程中引导OCT探头(图6),以确保采集数据的可靠性,即在患者随访的不同次扫描之间有良好的重叠性(至少80%重叠)。同时LIAF引导还能帮助操作者快速识别和定位口腔组织上的感兴趣区域。

图6 使用LIAF相机为OCT探针对准进行“粗配准”的举例。探针根据重叠的边缘检测图像对准。对准使OCT和OCTA数据有良好的重叠用于点云配准。
在临床实用性方面,LIAF不但可帮助操作者识别口腔组织中出现异常的区域,并允许快速捕获OCT图像,大大减少了扫描时间,有助于改善患者体验。本研究记录了整合LIAF前后的扫描时间(表1),共10名患者(整合LIAF前后各5名),发现整合LIAF后,瞄准感兴趣区域的平均时间减少了111s(约2
min)。扫描间差异也减少了,意味着在患者不自主运动存在的情况下,依旧可靠地重新瞄准感兴趣区域。
03-PAF、OCT和OCTA对牙菌斑的定性观察
为展示LIAF-OCT系统的全部功能,对比PAF、OCT和OCTA三种不同成像模式下斑块和周围组织的成像结果。成像部位是左侧切牙和左犬齿的齿间区域。

图7 (A,B)PAF成像的原始和后处理数据,显示存在牙菌斑。(C)正面OCT图像(表层150
μm以下)可见牙菌斑的位置,以及周围组织。(D)功能性OCTA提供微血管结构信息,可见柔软组织没有炎症或炎症极轻。(E,F)图C中绿色虚线位置的OCT
B-scan图像。
LIAF原始图像(图7A)经后处理显示存在牙菌斑(图7B)。OCT(图7C)和OCTA(图7D)图像分别展示了牙龈边缘的微结构和微脉管系统,可见牙龈边缘微结构呈明亮且光滑状态(图7C红色虚线)。几种成像方法得到斑块面积相似(表2)。正面OCT图像可显示斑块的大面积,因此选择它来与LIAF测量的斑块进行比较。大部分误差是由人工分割引起的,因为操作者必须目视选择要分析的区域(图7B和图7C)。基于这种方法,PAF和OCT在测量龈上菌斑方面没有显著差异(2-way
t-test,p<0.05)。平均值不同可能是仪器读数和测量方法误差所致。

OCT可以在血管造影术模式(OCTA)下运行,并以微米分辨率提供牙龈的3D脉管系统图像。在炎症过程中,血管增殖或血管舒张,导致炎症部位的毛细血管更多和/或血管更大。已知牙龈炎症可以通过OCT和OCTA成像在活体内进行观察和定量。当OCT/OCTA与PAF联合应用时,有可能评估牙龈边缘周围更具致病性的牙菌斑的初始发病情况,以及由此导致的牙龈结构和脉管系统的变化。
斑块积聚24h似乎不会在周围组织中引发任何可辨别的炎症反应,但也确实发现结缔组织产生不规则纹理,如正面OCT上的黑色条纹(图7C黄色虚线),OCTA微血管图像(图7D)进一步证实了这种异常,与该狭窄区域内的正常/健康区域相比,小毛细血管的数量减少。然而尚不清楚牙龈OCTA外观与斑块积聚有何联系,也许该微分辨率下的异常只是单纯的个体解剖特征。图7中给出的结果也证明了这两个系统作为互补对工作。由于OCT对光散射引起的组织光学特性敏感,因此由于其不同的光学特性,它可用于区分斑块和周围组织,从而测量总斑块。另一方面,PAF提供了斑块内卟啉数量的信息,表明了细菌的代谢产物。例如,在犬科部位(图7B中的黄色箭头)比在门牙部位(图7B中的蓝色箭头)观察到更多的细菌代谢活性。然而,通过OCT对牙龈边缘位置的牙菌斑的厚度测量分别为330μm(图7F)和197
μm(图7E)。
结论
LIAF-OCT集成系统满足了3D微成像所需的快速、宽视野、高性价比需求,可以解决临床中的诸多问题,如快速准确定位感兴趣结构、控制受试者的不自主运动、减少成像时间,此外还有检测生物膜累积情况等。在临床口腔状况跟踪中,LIAF-OCT系统具有非常大的应用潜力。随着技术的发展,该集成系统将帮助临床对病变状态做出更准确的评估和解释。
参考文献:
Le, Nhan , et al. "Noninvasive multimodal imaging by integrating optical coherence tomography with autofluorescence imaging for dental applications." Journal of Biophotonics (2020):e202000026.