
在皮肤创伤愈合过程中存在一系列复杂的级联事件,对这些事件进行体内成像是一项困难但重要的任务。目前的技术侵入性较强,或者对血管和结构的分辨率无法达到评估、监测和治疗所需的细节水平。为解决以上问题,研究人员Anthony J. Deegan等使用一个临床原型OCTA系统,成像、识别并跟踪了烧伤伤口愈合过程中,关键的血管和结构的适应性变化。测量了特定的血管参数,如直径和密度,从时间和空间角度确定了多个不同但重叠的伤口愈合阶段,并证明了皮肤创伤愈合多因素过程中的详细血管化和解剖属性。证明了OCT在临床创伤研究中的适用性。文章以“Optical coherence tomography angiography monitors human cutaneous woundhealing over time”为题发表于Quant Imaging Med Surg。
背景
在皮肤创伤,如烧伤、慢性皮肤溃疡和手术创伤等的治疗中,准确评估创伤情况对于制定有效的治疗计划至关重要。无论是误诊、治疗受阻或效果不佳,都可能会增加结疤或感染风险,导致发病甚至死亡。伤口愈合过程是一系列高度协调的级联事件,涉及多种细胞类型、生物活性分子和细胞外基质蛋白,形成四个不同但重叠的阶段:止血、炎症、增殖和重塑。已知皮肤的微血管系统在伤口愈合的各个阶段都起着关键作用,它们调节血液流动和组织灌注,促进氧气和营养物质的输送,并支持肉芽组织的形成。因此,识别和准确评估每个阶段的特征性血管变化,并将它们与结构变化相关联,可以为伤口愈合评估提供坚实基础。
评估伤口愈合一般通过视觉观察和表面测量来进行,如监测伤口的大小、颜色、气味、引流和焦痂。然而这种测量于皮肤表面,对于医疗人员的经验、伤口状况和治疗史依赖非常严重。Vancouver瘢痕量表和Manchester瘢痕量表等可以量化伤口评估结果,但也有明显的主观性缺陷。目前活组织检查的客观评估效果好,但会导致进一步的组织破坏,增加感染风险。随着技术的发展,磁共振成像(MRI)、超声成像、荧光成像、偏振敏感光学相干断层扫描(PS-OCT)以及激光多普勒血流测量(LDF)和灌注成像等,也已经探索用于评估伤口愈合,特别是烧伤伤口。然而也都存在一定的缺点,如LDF,虽然它是常用的非侵入性成像技术,但它对不同伤口情况的敏感性不足,且缺乏三维(3D)成像能力,限制了它在临床上的应用。
近年来,光学相干断层扫描技术(OCT)广泛用于眼科领域,而技术的进步,如改进激光源提高分辨率、使用相位信息提高灵敏度、加快扫描速度、扩大视野等,使得OCT在皮肤科应用成为可能。例如关于皮肤修复或再生,OCT结合其他技术,如多光子显微术和组织病理学,已经实现了监测小鼠和工程皮肤等效组织模型中的伤口愈合,以及皮肤替代物辅助的伤口愈合期间的疤痕形成。此外OCT也能够通过测量烧伤深度来确定烧伤严重程度,临床也有研究证明了OCT在这方面的适用性。在烧伤处理中,第二度烧伤的治疗通常较复杂,必须等待评估伤口是否能够自主愈合,然后才能决定是否进行植皮等手术干预,这意味着感染的机会增加。OCT能够帮助对烧伤严重程度进行早期评估,无需等待愈合迹象,从而加速治疗和恢复。
此外,对OCT可利用移动的红细胞的散射特性来识别组织内的功能性血管,构建了基于OCT的血管造影术,即OCTA技术。其中光学微血管造影术(OMAG)具有较高的灵敏度,且已成功用于小动物模型和人体组织如皮肤和眼睛的功能性血管可视化。OMAG对组织床内动态血液灌注成像的发展被誉为传统OCT重要的扩展之一,并已成功转化用于临床眼科成像。本文提出了一个临床原型OMAG系统,它是专门为皮肤病应用设计的,用于高分辨率监测健康皮肤伤口愈合过程中的微循环和结构特征。
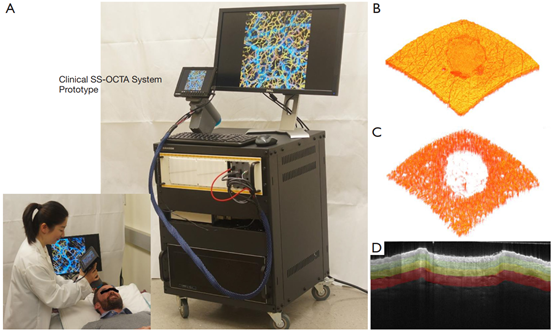
图1 临床原型OCT系统以及成像和数据收集步骤。(A)临床原型swept-source OCTA系统。(B)伤口的OCTA 3D体积式扫描结果。(C)从体积式扫描结果获得的血管数据。(D)截面B-frame图像,基于表皮和层的特征,将OCTA体积式图像分成三部分,分别代表乳头状层(265–530 μm)、下乳头状/上网状层(530–795 μm)和网状层(795–1200 μm)。
结果
01-不同时间的血管特征
图3为同一个伤口44天的成像结果总结。左侧栏为正常对照皮肤。可见正常皮肤中,脉管分布均匀(图3A),截面B-frame中也可见相对均匀的脉管分布和结构,此外血管直径如预期随深度增加(图3K)。
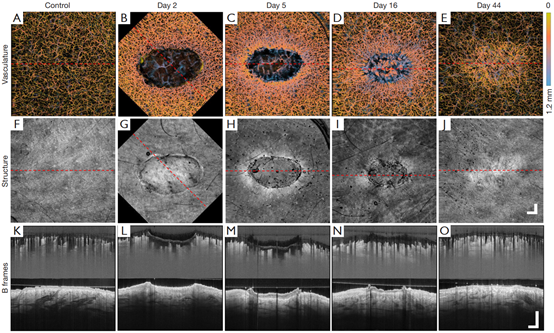
图3 MINP正面投影的全体积扫描显示正常和愈合中皮肤的血管和结构特征。(A-E)正常和愈合状态的正面血管图像。(F-J)正常和愈合状态下的正面结构图像。红色虚线为相应的截面B-frame拍摄位置。(K-O)正常和愈合状态下脉管系统(顶部)和结构(底部)的截面B-frame。
与正常皮肤相比,伤口周围和紧邻伤口下方的血管出现扩张(图3B)。在图3C和D中可以看到新生态的血管向伤口中迁移,以及更发达的血管芽。图3D中还可看到外周血管舒张减少,伤口内出现更深的大血管。图3E中已不再可见处于新生状态的血管,并且血管扩张仅在伤口区域出现血管扩张。图3L,M伤口正下方可见两个明亮区域,可能是代表热损伤的胶原,而图3N,O中没有这个特征。
02-不同时间的结构特征
正常皮肤显示出平滑的皮肤结构(图3F),截面B-frame显示表皮完整、厚度一致且结构亮度均匀(3K),此外表皮正下方亮度增加,可能是乳头状的高度组织化的细胞外基质。
对比损伤后不同时间,可以清楚地看到纤维蛋白凝块(图3G),后变成焦痂(图3H)。紧邻伤口周围的组织看起来更亮(图3G)。在图3H、I和J中可看到进行性的伤口收缩。图3J中伤口已不可见,只有漩涡状的图案,很可能是由于Ⅲ型胶原转化为Ⅰ型胶原导致的胶原量增加。图3M可见焦痂、增厚的表皮和表皮舌,图3O显示了增厚的表皮和紧接下方的更亮的(与图3I中明亮漩涡图案一致)。
03-深度特异性血管特征
图4为损伤后44天的深度特异性血管特征。分别代表乳头状层(265–530 μm)、下乳头状/上网状层(530–795
μm)和网状层(795–1200 μm)。血三个解剖层中的每一层的血管分布都是均匀的,血管直径和密度似乎都随着深度的增加而增加。
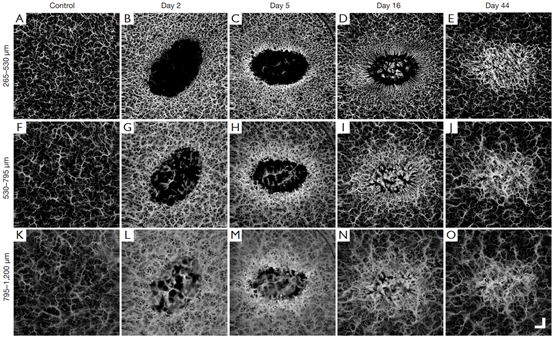
图4 MIP正面投影血管图像显示随时间变化的深度特异性血管特征。图中所示为三块分段板,代表深度(A-D):265–530μm(乳头状);(F-J):530–795μm(下乳头/上网状);和(K-O):795-1200μm(网状)。从左到右,分别在正常皮肤、损伤后第2天、第5天、第16天和第44天的扫描中获得图像。
对比愈合中的图像可发现,无论深度如何,伤口周围都有均匀分布的舒张的血管,且伤口内的血管舒张似乎由网状的较深血管支配(图4B、G、L)。仅在上层可见血管生成芽,即乳头状和下乳头状/上网状层中(图4C,H),这些未成熟的新生态血管也比其周围血管更亮。如图4D,I,N可见从网状萌发的血管新生热潮。如图4E,J,O表明仅位于重塑伤口区域的血管舒张。
04-深度特异性结构特征
图5为损伤后44天的深度特异性结构特征。可见正常皮肤中虽然每层之间的特征不同,但都完整且分布均匀。
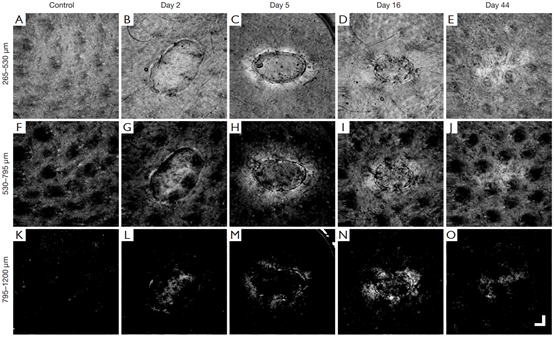
图5 MIP正面投影结构图像显示随时间变化的特定深度结构特征。图中所示为三块分段板,代表深度(A-E):265–530μm(乳头状);(F-J)530–795μm(下乳头/上网状),和(K-O)795–1200μ
m(网状)。从左到右,分别正常皮肤、损伤后第2天、第5天、第16天和第44天。
在愈合过程中,虽然可以在上层中清楚地看到伤口收缩(图5B-E),但在第二层即下乳头/上网状中,似乎愈合过程明显(图5G-J)。在早些时间点,伤口内的组织结构似乎仍然具有类似于未受损皮肤的特征(图5G,F)。然而,如5H中伤口内的结构已经完全改变,伤口现在看起来几乎没有特征,除了紧邻的组织明亮。如图5I所示,组织结构似乎正在正常化。损伤后44天的图像中可见,结构与正常皮肤的特征非常相似(图5E、J、O),胶原蛋白周转产生的漩涡模式是伤口存在的唯一迹象。
05-定量测量
图6为各种血管参数的量化结果。分别在损伤后第2、5、9、16、23和44天扫描三层组织中的血管。图6A为从整个受影响区域(即伤口和周围皮肤)获得的血管直径测量值。就血管直径而言,三个血管层中各不相同,范围从乳头状的约27
μm(± 1 μm)到网状的约67 μm(± 2 μm)(one-way
ANOVA,P<0.0001)。受伤导致的血管直径增加在较深处血管中为显著,随着血管变得更浅其显著性降低(下乳头/上网状,P =
0.0011;网状,P =
0.0019;乳头状,P=0.014)。到第16天,三层血管都正常化了。这些发现证实了前面的正面投影图像(图3)。网状是第16天后唯一显著改变的血管层(P
= 0.0004),再次证实了之前的观察结果。
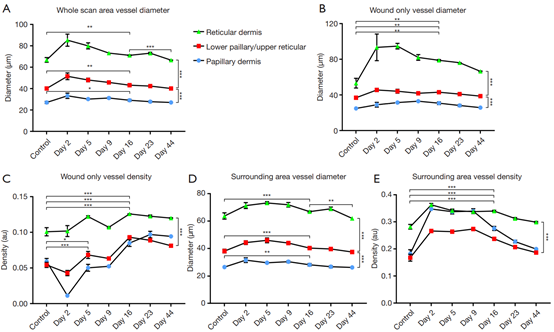
图6 整个愈合过程中血管参数的量化。(A)全扫描区的血管直径;(B)伤口区域血管直径;(C)伤口区域血管密度;(D)周围区域血管直径;(E)周边区域血管密度。*,P≤0.05;**,P≤0.01;***,P≤0.001;和****,P≤0.0001。
图6B为仅伤口内的血管直径测量值。同样,每个血管层彼此不同,范围从乳头状的约25 μm(± 1 μm)到网状的约53 μm(± 5
μm)(P<0.0001)。不同血管层之间的血管直径无显著差异(乳头状,P = 0.0065;下乳头/上网状,P =
0.0064;网状,P=0.0043)。
图6C为仅伤口内部的血管密度测量。就血管密度而言,较上层的乳头状与下乳头状/上网状彼此之间没有差异,但与较深层的网状间有差异(unpaired t-test,P=0.0001)。就愈合后血管密度变化程度,三层间彼此不同。创伤早期,浅表血管层中血管密度降低显著,随后降低减少[乳头状,P
= 0.0003;下乳头/上网状,P =
0.014;网状,P=0.06(ns)]。在研究期间,也观察到了类似的趋势。较上层血管密度的总体变化为显著,之后逐渐减弱(乳头状,P
< 0.0001;下乳头/上网状,P <
0.0001;网状,P=0.0006)。,这些数据与视觉观察结果一致,证实了大多数皮肤损伤位于上面的血管层中。
图6D为仅从伤口周围皮肤获得的血管直径测量值。每个血管层间彼此不同,血管直径的增加与血管深度的增加相关(unpaired t-test,P<0.0001)。对于愈合后血管直径的变化,三层血管直径均增加,显著性程度与血管深度相关,即血管越深,血管直径增加越显著(乳头状,P
= 0.0049;下乳头/上网状,P =
0.0005;网状,P=0.0006)。OCT图像观察到所有三层都血管舒张(图4),但是目测无法阐明深度特异性的显著程度。根据第16天的结果标准化后,网状再次成为唯一直径增加的血管层(P=0.0019)。这种趋势以前在目视检查中没有发现。
图6E为仅从伤口周围皮肤进行的血管密度测量。与伤口内类似,上面两个血管层即乳头状和下乳头状/上网状,血管密度彼此没有不同。然而,深的网状更致密(unpaired t-test,P=0.0003)。虽然愈合会使所有三层的血管密度都而增加,但就增加的显著性程度而言,三层之间没有差异(乳头状,P < 0.0001;下乳头/上网状,P < 0.0001;网状,P<0.0001)。
综合考虑,血管密度的变化,特别是浅的血管中的血管密度变化,是伤口内的主要应答反应;而血管直径的变化,特别是在较深的血管中,是周围组织的主要反应。
06-伤口收缩
在评估伤口愈合时经常使用的一个参数是伤口收缩。本研究也测量了伤口收缩率(图8),但它并不是愈合的主要衡量标准。在皮肤松弛的动物中,如小鼠,测量伤口收缩可以作为愈合过程健康的指标,因为在这种情况下收缩是愈合的主要途径。但在人类中,伤口收缩可能不仅仅依赖伤口收缩,而是再上皮化。
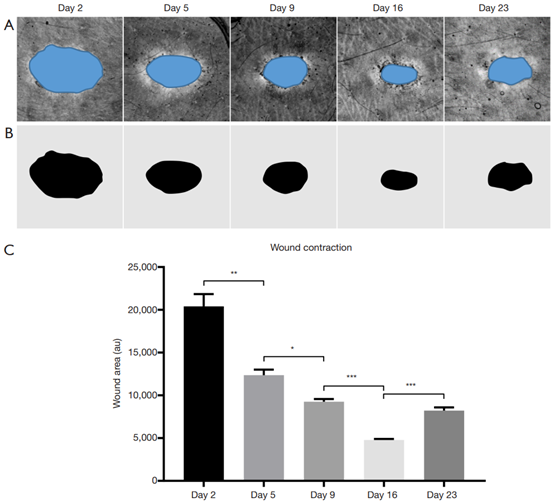
图8 伤口收缩定量。(A)伤口的MIP正面投影结构图像。蓝色为用于定量的伤口区域。(B)对应产生的阳性信号。(C)伤口收缩率。P≤0.05; **, P≤0.01; ***, P≤0.001
结论
在这项研究中,使用OCT和OCTA/OMAG,非侵入性地检测了与人类皮肤伤口愈合的多个阶段相关的各种血管和结构特征随时间的发展变化情况。成功以毛细血管水平分辨率识别了许多关键的血管适应行为,并将它们与结构改变相关联。虽然本研究存在一定的局限性,如研究主题、分析方法单一,且伤口尺寸和数据规模较小,但这并不影响数据有效性,而且通过监测皮肤伤口愈合也展示了OCT技术和相关分析技术的新进展。进一步的研究可以考虑选择损伤范围更大的参与群体,在各种场景中的不同条件下评估和发展OCT技术,从而扩大OCT/OCTA的适用性。此外还应采用其他分析技术来证实OCT/OCTA的发现。
OCT/OCTA提供了一个非侵入性成像特定血管适应性行为的方法,这种适应性行为发生在人类皮肤伤口愈合的许多阶段。随着不断的发展和完善,它可能帮助确定伤口严重程度和可能的愈合结果,为患者提供更具体和的未来治疗选择。
参考文献:
Deegan, Anthony J. , et al. "Optical coherence tomography angiography monitors human cutaneous wound healing over time." Quantitative Imaging in Medicine and Surgery 8.2(2018):135-150.